
Die Bedeutung gekochter Eier für die Wissenschaft

Ein Forschungsteam unter Leitung der Universität Siegen hat analysiert, welche Prozesse beim Kochen von Eigelb auf kleinsten Längenskalen von Nanometern ablaufen. Die Ergebnisse sind von Bedeutung in der Biophysik, der Medizin sowie für die Pharma- und Lebensmittelindustrie.
Die einen mögen es glibberig, andere schwören auf wachsweich, und wieder andere lieben es hartgekocht: Die Rede ist natürlich vom Ei. Ein Forschungsteam unter Leitung der Universität Siegen hat sich in den vergangenen drei Jahren intensiv mit dem Kochen von Eigelb beschäftigt. Allerdings kam der Untersuchungsgegenstand nicht in den Topf, sondern wurde in eine 1,5 Millimeter dünne Kapillare abgefüllt und dann Röntgenstrahlung ausgesetzt. Ziel war auch nicht das perfekte Frühstücksei: Die Wissenschaftler*innen haben im Forschungszentrum DESY in Hamburg die Strukturveränderungen im Eigelb während der verschiedenen Phasen des Erhitzens analysiert.

„Wir wollen die Dynamiken in dichten Proteinlösungen verstehen“, erklärt Prof. Dr. Christian Gutt, Physiker an der Uni Siegen. Wie tragen die verschiedenen Bestandteile des Eigelbs, wie z.B. Fettmoleküle und Proteine, dazu bei, dass sich beim Erhitzen die weichkörnige Gel-Mikrostruktur entwickelt? Um das herauszufinden, wurde das Eigelb mit Strahlung aus PETRA III, eine der hellsten Speicherring-Röntgenstrahlungsquellen der Welt, untersucht. Die Proben wurden bei Temperaturen zwischen 63 und 100 Grad Celsius über einen Zeitraum von bis zu zwei Stunden beobachtet. Dabei stellten die Forscher*innen fest, dass die Entwicklung der Gel-Mikrostruktur unabhängig von der Temperatur ist. Aber: Je höher die Temperatur, desto schneller läuft dieser Prozess ab. Aus den Daten konnte das Team ein allgemeines Zeit-Temperatur-Phasendiagramm erstellen. Die Geschwindigkeit des Prozesses nimmt fast exponentiell mit der steigenden Temperatur zu.
Doch was tun mit diesen Erkenntnissen? „Die Prozesse, die beim Erhitzen von Eigelb in Millisekunden ablaufen, gehen auch im menschlichen Körper, in biologischen Systemen generell, vonstatten – allerdings sehr viel langsamer“, erklärt Dr. Nimmi Das Anthuparambil, gemeinsame Postdoktorandin an der Uni Siegen und von DESY und Erstautorin der Studie. „Die sogenannte Denaturierung und Aggregation von Proteinen tritt beispielsweise in Zusammenhang mit der Entstehung von Krankheiten wie Alzheimer, Parkinson oder Atherosklerose auf.“
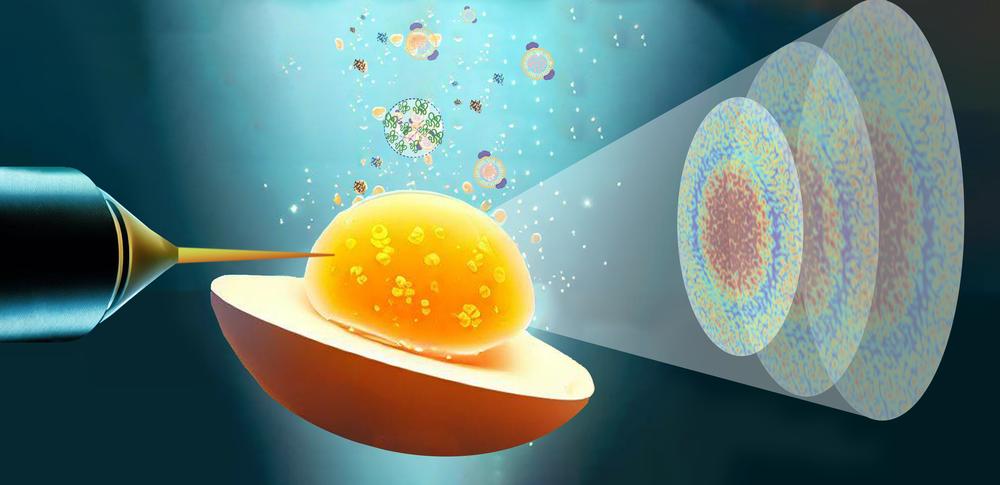
Die Erkenntnisse des Forschungsteams der Uni Siegen, der Universität Tübingen, von DESY und der TU Dortmund sollen helfen zu verstehen, was genau bei der Entstehung dieser Krankheiten passiert. Auch für die Entwicklung moderner Medikamente sind die Erkenntnisse von Bedeutung. Denn die proteinbasierten Arzneimittel sind besonders instabil – eine Herausforderung für die Pharmaindustrie.
„Das besondere an der Studie ist die Erkenntnis, dass die Denaturierung und Aggregation komplexer Systeme wie Eigelb doch relativ einfachen physikalischen Gesetzen gehorcht. Wir bleiben auf jeden Fall dran, Folgeprojekte mit Proteinen aus dem Bereich der Alzheimerforschung und der Coronaviren sind bereits auf dem Weg“, sagt Prof. Gutt. Die Studie wird vom Bundesministerium für Bildung und Forschung gefördert. Das Forschungsteam hat die neuen Erkenntnisse in der renommierten Fachzeitschrift Nature Communications kommuniziert.

Fotos (von oben):
Prof. Dr. Christian Gutt von der Universität Siegen leitet das internationale Forschungsprojekt. (Quelle: Universität Siegen)
Illustration der Untersuchung: Mit Hilfe der Röntgenphotonen-Korrelationsspektroskopie fanden die Forschenden heraus, wie die Bestandteile im Eigelb eines Hühnereis dazu beitragen, dass sich beim Erhitzen dessen weichkörnige Mikrostruktur entwickelt. (Quelle: Universität Siegen, Marie Abhag Louise)
Die Strahlführung P10 an DESYs Röntgenlichtquelle PETRA III, an der die Experimente stattgefunden haben. (Quelle: Universität Tübingen, Anastasia Ragulskaya)
Aktualisiert um 18:20 am 16. Oktober 2023 von Thomas Reppel.






