
Mit Röntgenblitzen zu neuen medizinischen Erkenntnissen

ForscherInnen – unter anderem der Universität Siegen – haben ein neues Verfahren am Röntgenlaser European XFEL entwickelt, um Proteinbewegungen in zellähnlichen Umgebungen sichtbar zu machen. Das könnte zum Beispiel dabei helfen, neue Medikamente zu entwickeln und die Entstehung von Krankheiten zu erforschen.
Proteine sind für viele biologische Funktionen im Körper verantwortlich, und das Verständnis ihrer Bewegungen in Zellen und zellähnlichen Umgebungen ermöglicht es Wissenschaftlerinnen und Wissenschaftlern, mehr über die Entwicklung von Medikamenten und die Entstehung von Krankheiten zu erfahren. Nun hat ein internationales Forscherteam einen neuen Weg gefunden, diese Proteindynamik zu untersuchen, indem es die hohe Wiederholrate und die hohe Kohärenz der Röntgenblitze des Röntgenlasers European XFEL in Hamburg nutzt. Die Studie, die in Nature Communications veröffentlicht wurde, nutzt eine als Megahertz-Röntgenphotonen-Korrelationsspektroskopie (MHz-XPCS) bezeichnete Technik und könnte neue Anwendungen in den Bereichen Gesundheit und Pharmazie eröffnen.
Die Studie unter Leitung von Forschenden der Universität Stockholm, der Universität Tübingen, der Universität Siegen und des European XFEL nutzte die MID-Experimentierstation (Materials Imaging and Dynamics), um Lösungen von Antikörperproteinen zu untersuchen. Der Röntgenlaser erzeugt dabei Millionen von Blitzen pro Sekunde und ermöglicht es so den Forschenden, Bilder von Proteinen mit molekularer Auflösung aufzunehmen, und Abläufe zu beobachten, die kürzer als eine Mikrosekunde (millionstel Sekunde) sind.
Die Kombination aus hohen Pulsraten und hochenergetischer Strahlung bei Röntgenlasern kann die untersuchten Proteine schädigen oder selbst Reaktionen auslösen. Mit einer geringeren Röntgenstrahlendosis haben die Forscher jedoch eine Möglichkeit gefunden, die Veränderungen der Proteine zu untersuchen, bevor eine Schädigung eintritt, und gleichzeitig die Auswirkungen des Röntgenstrahls auf die Bewegung der Proteine zu messen.
„MHz-XPCS mit niedriger Dosis ist eine Methode, mit der wir die Dynamik von Proteinen auf eine Art und Weise untersuchen können, die bisher nicht möglich war“, sagt Anders Madsen, Co-Autor der Studie und als leitender Wissenschaftler bei European XFEL verantwortlich für die MID-Experimentierstation. „Durch die Kombination der hohen Pulsrate des European XFEL mit einer reduzierten Strahlungsdosis können wir neue Erkenntnisse über die Verhaltensweisen dieser Proteine gewinnen.“
„Die Reaktionen von Proteinen auf kleinen Skalen, Mikrosekunde für Mikrosekunde, sind eng mit Wechselwirkungen verbunden, die eine Reihe ihrer Eigenschaften bestimmen“, fügt Madsen hinzu. „Neue Erkenntnisse in diesem Bereich kann Wissenschaftlern dabei helfen, neue, modernere Medikamente zu entwickeln und unser Verständnis von Krankheiten zu verbessern.“
Mit MHz-XPCS können die Forscher nun auch das kollektive Verhalten vieler Proteinmoleküle auf einmal untersuchen. Dazu verwendete das Team eine hochkonzentrierte Immunglobulin-Proteinlösung, die die komplexe Umgebung einer Zelle nachahmt, in der sich viele Proteine gleichzeitig befinden.
„Viele Faktoren beeinflussen die Proteine in der überfüllten Umgebung unserer Zellen, die alle die Bewegung der Proteine verlangsamen und behindern“, sagt Prof. Foivos Perakis von der Universität Stockholm. „Studien zeigen auch, dass sich Proteine in überfüllten zellulären Räumen anders verhalten als in anderen Systemen. All diese Faktoren müssen berücksichtigt werden, um ein vollständiges Verständnis dieser Systeme zu erhalten.“
Die Studie eröffnet nicht nur einen neuen Weg zur Erforschung der Proteindynamik, sondern hat auch zu neuen Erkenntnissen über die Antikörperproteine selbst geführt, wie zum Beispiel zur Veränderung der Diffusion von Proteinen in einer Lösung in Abhängigkeit von der angewandten Strahlendosis.
„Wenn Medikamente in unseren Blutkreislauf gelangen, binden sie an Proteine, die sie im Körper transportieren und verteilen“, erklärt Prof. Christian Gutt von der Universität Siegen und ebenfalls Autor der Studie. „Ein umfassendes Verständnis dieser Prozesse könnte zu wirksameren Behandlungen mit weniger Nebenwirkungen führen.“
Das Team will nun seine neue, niedrig dosierte MHz-XPCS-Technik einsetzen, um die Lücke in unserem Wissen über Proteine zu schließen, wo bisherige Messverfahren nicht eingesetzt werden konnten.
„Die Röntgenphotonen-Korrelationsspektroskopie, kombiniert mit der hohen Wiederholrate des European XFEL, kann diese relevanten Messparameter zugänglich machen“, schließt Dr. Fajun Zhang, Wissenschaftler an der Universität Tübingen. „Vor allem kann sie Informationen über Prozesse liefern, die wir nur begrenzt verstehen, wie etwa die Bildung von Proteinansammlungen in den Zellen.“
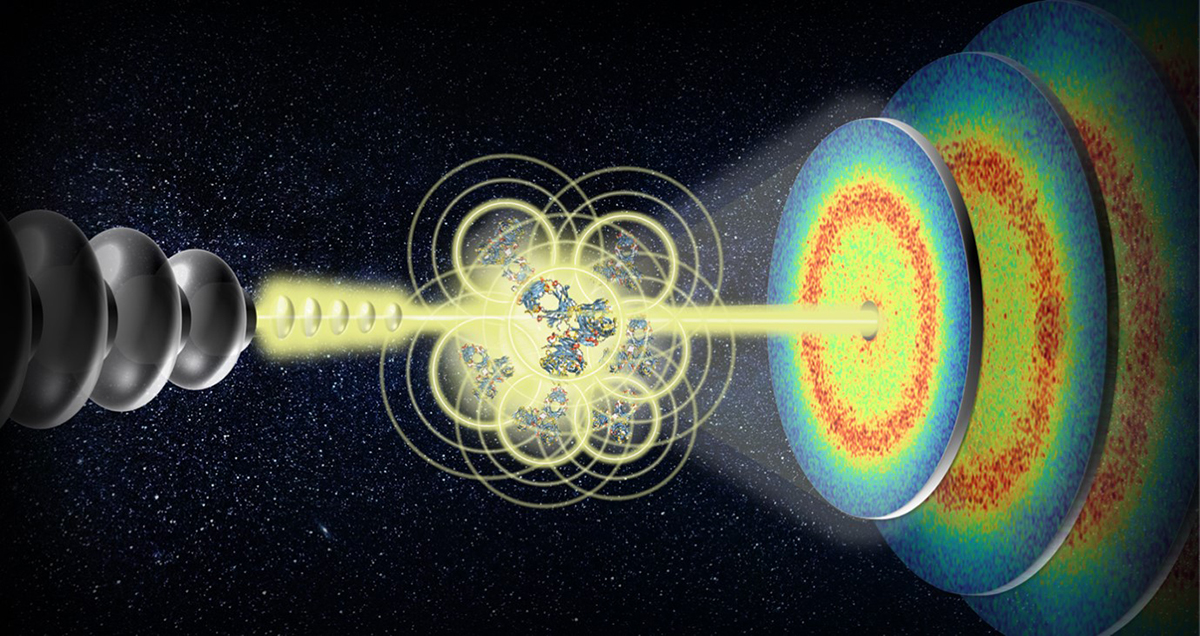
Darstellung der MHz-XPCS-Technik, die zur Messung der Dynamik von Proteinen in dichten Lösungen eingesetzt wird.
Publikation: Resolving molecular diffusion and aggregation of antibody proteins with megahertz X-ray free-electron laser pulses
M. Reiser*, A. Girelli, A. Ragulskaya, S. Das, S. Berkowicz, M. Bin, M. Ladd-Parada, M. Filianina, H.-F. Poggemann, N. Begam, M. S. Akhundzadeh, S. Timmermann, L. Randolph, Y. Chushkin, T. Seydel, U. Boesenberg, J. Hallmann, J. Möller, A. Rodriguez-Fernandez, R. Rosca, R. Schaffer, M. Scholz, R. Shayduk, A. Zozulya, A. Madsen, F. Schreiber, F. Zhang, F. Perakis* and C. Gutt* [*corresponding authors] Nat Commun. 13, 5528 (2022)n https://doi.org/10.1038/s41467-022-33154-7
Kontakt:
Prof. Dr. Christian Gutt, Universität Siegen
gutt@physik.uni-siegen.de
Aktualisiert um 12:28 am 28. September 2022 von g040107.






