Computer simuliert Corona-Infektion beim Menschen
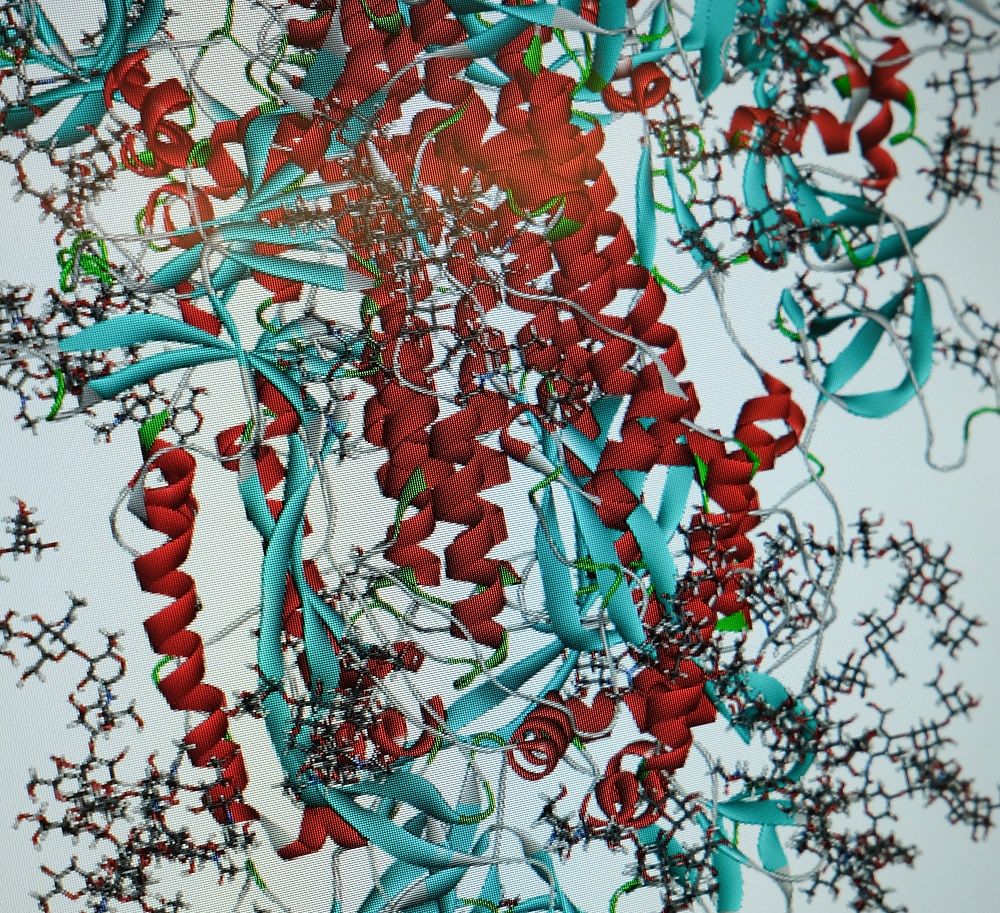
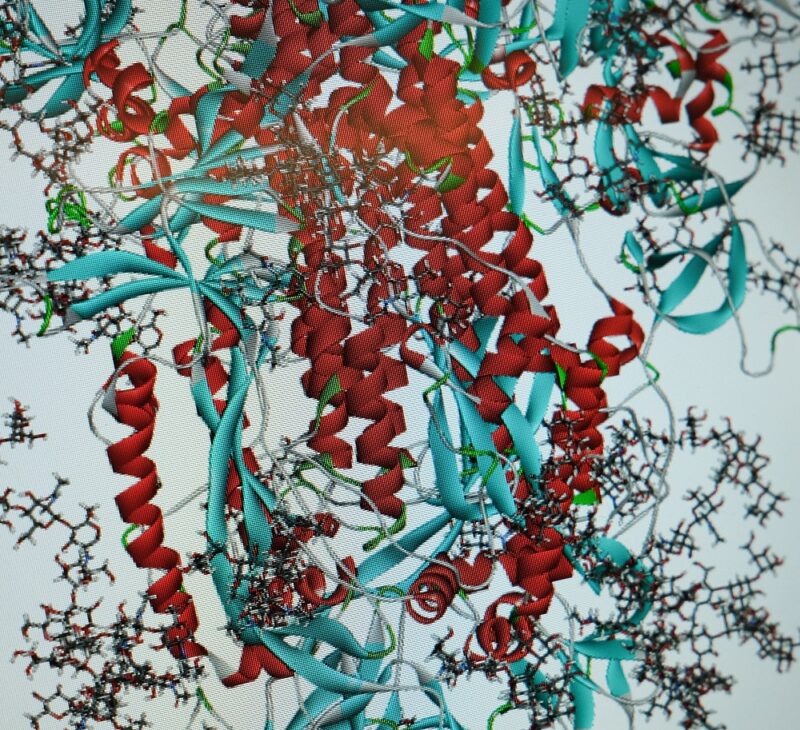
Forschern der Theoretischen Chemie an der Universität Siegen ist es gelungen, die Anfangsprozesse des Eindringens des Corona-Virus in menschliche Zellen mit Hilfe des Supercomputers OMNI zu berechnen. Die Ergebnisse von PD Dr. Stephan Bäurle und Thanawat Thaingtamtanha könnten wichtige Ansätze für die Entwicklung von Corona-Medikamenten liefern.
An Medikamenten gegen Covid 19 wird auf der ganzen Welt geforscht. Je besser man das Virus und die Prozesse der Verbreitung im Körper kennt, desto eher ist es möglich, Ansatzpunkte einer Behandlung zu finden. In den experimentellen Laboren wird derzeit dazu sehr intensiv gearbeitet. Aber auch Simulationen spielen eine große Rolle. Chemische, zelluläre Abläufe bei einer Infektion mit dem SARS-CoV-2-Virus können mit dem Computer modelliert werden. Voraussetzung ist ein Hochleistungsrechner, wie ihn die Universität Siegen mit dem neuen OMNI Cluster besitzt. Dieser Supercomputer bietet PD Dr. Stephan Bäurle, der die Leitung des Arbeitskreises für Theoretische Chemie an der Universität Siegen innehat, die Möglichkeit, an der Aufklärung der Mechanismen verschiedener Krankheiten zu arbeiten.
Gemeinsam mit seinem Master-Studenten Thanawat Thaingtamtanha hat Bäurle nun Berechnungsverfahren entwickelt und verwendet, mit denen die Anfangsprozesse des Eindringens des Corona-Virus in die menschliche Zelle auf atomistischer, also kleinster, Ebene beschrieben werden kann. Dabei ist es den Forschern gelungen, diese Abläufe so zu simulieren, dass es neue Erkenntnisse über den Mechanismus der Fusion zwischen den Stacheln auf der Oberfläche der Virusmembran und der Membran der menschlichen Zellen gibt. In der Computersimulation kann man nachverfolgen, wie der Infektions- und Vermehrungsprozess des Virus, das in den menschlichen Körper eingedrungen ist, auf molekularer Ebene in Gang kommt. „Wenn man das weiß, kann man versuchen, die Schwachstellen im Ablauf aufzuspüren, um die virale Replikation zu unterbrechen“, erklärt Bäurle. An diesem Punkt könnten dann antivirale Medikamente ansetzen. Der Vorteil: Auch deren Wirkung kann mithilfe von Computersimulationen abgeschätzt werden, bevor Forscherinnen und Forscher experimentell im Labor weitere Schritte unternehmen.
Für die Siegener Forscher sind detaillierte Kenntnisse über die molekularen Prozesse beim Eindringen des Corona-Virus in die Wirtszelle Voraussetzung für die Entwicklung neuer Medikamente. Beim Corona-Virus spielen zwei Schlüsselproteasen die Hauptrollen: TMPRSS2 und Furin. Proteasen sind körpereigene Enzyme, die wie „Werkzeuge“ auf molekularer Ebene agieren. Furin arbeitet wie eine Schere und sorgt mit einem „Schnitt“ von spezifischen Proteinen dafür, dass diese in Zellen „aktiv“ werden. Diese Aktivierung ist wichtig, um körpereigene Prozesse anzuregen. Corona-Viren des Typs SARS-CoV-2, die man gern als runde Kügelchen mit spitzen Stacheln darstellt, haben aber leider, im Gegensatz zu anderen Corona-Viren, an eben diesen Stacheln (Spike-Proteine) charakteristische Stellen, die dem Furin signalisieren, dass ein Schnitt erfolgen muss (sog. Furin-Spaltstellen). Dabei besteht jedes Spike-Protein aus drei Untereinheiten (Heteromere) mit jeweils einer Furin-Spaltstelle. Die Spaltstellen befinden sich am Ende jedes Heteromers, wo es eine Art Gabelung in zwei Äste (S1 und S2) gibt. Das Furin tut, was es tun muss. Es „schneidet“ an der Spaltstelle einen „Ast“ ab und ermöglicht so das Eindringen des Virus in die gesunde Zelle. Der Vermehrungsprozess kann beginnen.
Bäurle und sein Team konnten durch groß angelegte atomistische Berechnungen diesen Mechanismus noch genauer aufzeigen und beschreiben, wie sich an der Zellmembran der Wirtszelle eine „Tür“ für das Spike-Protein öffnet. Als „Türöffner“ fungiert ein ACE-2-Rezeptor. „Wir konnten zeigen, dass die Bindung des ACE2-Zellrezeptors an eines der Heteromere des Spikes zu einer verstärkten Bindung von Furin führt, die wiederum die Bindung der Protease TMPRSS2 fördert“, so Bäurle. Hieraus lässt sich schlussfolgern, dass Furin die Fusion des Virusstachels mit der Zellmembran beschleunigt, so dass das Virus schließlich sein Erbmaterial in die Wirtszelle besser einschleusen und sich dort leichter vermehren kann.
Die Ergebnisse der Arbeit im Arbeitskreis Theoretische Chemie am Department Chemie und Biologie wurden erst kürzlich publiziert (https://link.springer.com/article/10.1007/s00894-022-05206-8). Bäurle hofft, dass die beschriebenen Erkenntnisse zur Entwicklung von Therapien für Patientinnen und Patienten beitragen können – und das nicht nur bei Covid 19. Es ist seit längerem bekannt, dass eine fehlregulierte Aktivität von Furin zu einer Vielzahl von Erkrankungen, wie Krebs, Diabetes, Entzündungen, neurologische sowie kardiovaskuläre Erkrankungen, führen kann. „Die Ergebnisse unserer Arbeit deuten darauf hin, dass Risikofaktoren, die mit einem erhöhten Furinspiegel einhergehen, die Virulenz der Virusinfektion durch SARS-CoV-2 steigern“, so Bäurle.
Die Siegener Wissenschaftler der Theoretischen Chemie konnten mit ihrer Arbeit der Corona-Forschung ein Mosaikstein hinzufügen. „Wir wollen mehr wissen und mit unserer Arbeit einen Beitrag leisten im Kampf gegen das Virus. Und über die Zusammenarbeit, zum Beispiel mit der Humanbiologie unserer Universität, aber auch durch den Austausch in größeren Forschungsnetzwerken, können weitere hinzukommen“, hofft der Wissenschaftler.

Aktualisiert um 12:51 am 15. September 2022 von Thomas Reppel.






